Вещество, распространенное в большей мере в форме резко пахнущего бесцветного газа, и представляющее собой нитрид водорода, широко известно как аммиак. Сферы его применения разнообразны. Химическое соединение используют для изготовления удобрений с азотом, соды, взрывчатых веществ, полимерных составов и иных промышленных продуктов. В жидкой форме вещество применяют как растворитель, в твердой оно представляет собой кубические кристаллы. В его составе один атом азота и три — водорода.
Синтетический аммиак незаменим в производстве азотных удобрений.
Вячеслав ЖвирблисСодержание статьи
- Производство
- К какому классу веществ относится аммиак
- Области применения аммиака
- в производстве
- в холодильных установках
- в медицине
- Какая формула у аммиака
- Свойства NH₃
- Воздействие аммиака на физиологию
- Некоторые факты об аммиаке
Из этой статьи вы подробнее узнаете о том, где используют аммиак, как его получают в промышленности, как выглядит химическая формула, где используется в медицине, в производстве, к какому классу опасности относится аммиак.
Производство
Ежегодно в мире химические предприятия выпускают порядка 180 миллионов тонн аммиака. Как образуется аммиак? В результате непосредственного соединения водорода и азота, при протекании химической реакции с выделением тепла:
N2 + 3NH3 + 91,84 кДж
Наибольший выход аммиака 30% достигается при температуре 500°C и давлении в 350 атмосфер, притом для протекания реакции используют катализатор — пористое железо с оксидом калия. Из чего делают аммиак на производстве, на заводе? Его синтезируют из азота и водорода при высокой температуре. К молекуле двухатомного азота добавляют три двухатомные молекулы водорода.

К какому классу веществ относится аммиак
Согласно классификации ГОСТ 12.1.007, данное вещество относится к малоопасным веществам и принадлежит к четвертому классу опасности.
Оно хорошо растворяется в воде. В жидкой форме оно почти не проводит ток и сильно преломляет свет. Его запах ощутим, если концентрация аммиачных паров достигает 37 мг/м³.
Рекомендуем к прочтению:
Области применения аммиака
В производстве
Из аммиака изготавливают азотсодержащие удобрения, полимеры, соду. Его используют как противоморозный компонент строительной смеси, а также для придания аромата цветам без запаха или для изменения их окраски.
В холодильных установках
Где еще используется аммиак? В системах охлаждения. Он служит хладагентом. В том числе с его помощью охлаждают каналы энергоснабжения МКС.
В медицине
Используется для нанесения на поверхность кожи, ингаляций и приема внутрь, для приведения в сознание человека при обмороке. Аммиак применяют при укусах насекомых, невралгии, для повышения давления, для очищения поверхностей, в том числе рук хирурга.

Какая формула у аммиака
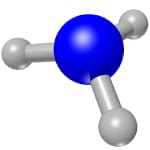
Формула вещества — NH3. Его молекула представляет собой пирамиду, где в основании атомы водорода, а наверху — атом азота.
Свойства NH₃
Аммиак — комплексообразователь. Его раствор, известный как нашатырь, обладает слабощелочной реакцией. При взаимодействии с кислотами, производит соли аммония. Вещество также слабая кислота. Взаимодействуя с металлами, оно образует соли.
Аммиачные растворы амидов — проводники тока. Нагреваясь, аммиак разлагается. Вещество горит в атмосфере кислорода, продукты горения — вода и азот. Хлор и йод под воздействием аммиака формируют взрывчатые вещества. При температуре 1000°C NH3 реагирует с углем, в результате образуется синильная кислота. Аммиак реагирует и с метаном, продукт реакции тот же.
Воздействие аммиака на физиологию
Воздействие паров NH3 приводит к раздражению слизистой и кожи. Такое раздражение воспринимается рецепторами как резкий запах, проявляется слезотечением, потерей зрения вследствие химического ожога, кашлем, зудом. Если сжиженный аммиак касается кожи, ее обжигает, на ней могут появиться пузыри. Испаряясь, он поглощает тепло, а касаясь кожного покрова при испарении, вызывает обморожение.

На производстве допустима максимальная концентрация аммиака в воздушной массе 20 мг/м³. Предельная среднесуточная концентрация вещества в помещении — 0,04 мг/м³. Допустима разовая концентрация аммиака в воздухе — 0,2 мг/м³. Если нормы превышаются, то в воздухе ощущается запах аммиака.
Когда в воздухе содержится 280 мг/м³, то раздражается зев, 490 мг/м³ — глаза, от 7 г/м³ — кожный покров. Легкие отекают, если аммиак в концентрации 1,5 г/м³ воздействует на человека в течение часа. Если кратковременно воздействовать аммиаком с содержанием в воздухе от 3,5 г/м³, то неизбежны общетоксические поражения.
Хотите получить консультацию?
Позвоните нам по телефону!Некоторые факты об аммиаке
- Пары нашатырного спирта (раствора аммиака в воде) могут менять окраску цветов. Лепестки синих оттенков они делают зелеными, насыщенно-красные — чернят.
- Аммиак наполняет облака над Юпитером.
- Не пахнущие в естественной среде цветы после воздействия на них аммиаком источают приятный аромат. К таким цветам относятся астры.
- Нашатырь, взаимодействуя с йодом, образует йодистый азот в виде кристаллов, таким образом проводят химические опыты с наглядными результатами.
Компания «Тантал-Д» с 1998 года поставляет аммиак и другие технические газы. Постоянным и оптовым клиентам предлагаем особые условия сотрудничества. У нас свой парк специализированного автотранспорта, при перевозках соблюдаем все требования безопасности. По Москве и Московской области доставляем заказы уже на следующий день после обращения. Оставляйте заявку на сайте или звоните, наши менеджеры ответят на все вопросы.
Источники:
- https://ru.wikipedia.org/wiki/Аммиак
- Общая и неорганическая химия. Н. С. Ахметов